|
|
eğitim öğretim ile ilgili belgeler > konu anlatımlı dersler > FEN BİLİMLERİ dersi ile ilgili konu anlatımlar
ELEKTRON, ELEKTRONLARIN ÖZELLİKLERİ, ELEKTRON ALIŞVERİŞİ VE SONUÇLARI (FEN BİLİMLERİ DERSİ KONU ANLATIM)
Atom iki kısımdan oluşur :
1-Çekirdek (merkez)
2-Katmanlar (yörünge; enerji düzeyi)
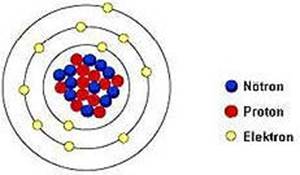
Çekirdek, hacim olarak küçük olmasına karşın, atomun tüm kütlesini oluşturur. Çekirdekte proton ve nötronlar bulunur. Elektronlar ise çekirdek çevresindeki katmanlarda bulunur.
![]() Elementlerin Çekirdekte bulunan protonlar,
atomun ( o elementin) tüm kimyasal ve fiziksel özelliklerini belirler.
Elementlerin Çekirdekte bulunan protonlar,
atomun ( o elementin) tüm kimyasal ve fiziksel özelliklerini belirler.
![]() Proton sayısı atomlar (elementler) için ayırt
edici özelliktir. Yani proton sayısının farklı olması elementin diğerinden
farklı olduğu anlamına gelir.
Proton sayısı atomlar (elementler) için ayırt
edici özelliktir. Yani proton sayısının farklı olması elementin diğerinden
farklı olduğu anlamına gelir.
![]() Elektronların bulunma olasılığının olduğu
bölgelere
elektron bulutu
denir.
Elektronların bulunma olasılığının olduğu
bölgelere
elektron bulutu
denir.
![]() Kimyasal olaylarda (reaksiyonlarda) yalnızca
elektron sayısı değişir. Proton ve nötron, çekirdekte bulunduğu için sayıları
değişmez.
Kimyasal olaylarda (reaksiyonlarda) yalnızca
elektron sayısı değişir. Proton ve nötron, çekirdekte bulunduğu için sayıları
değişmez.
![]() Nötr bir atom için; elektron sayısı= proton
sayısı
Nötr bir atom için; elektron sayısı= proton
sayısı
![]() (Z) Atom numarası= proton sayısı
(Z) Atom numarası= proton sayısı
![]() Çekirdek yükü= proton sayısı
Çekirdek yükü= proton sayısı
|
|
![]() İyon yükü= proton sayısı elektron sayısı
İyon yükü= proton sayısı elektron sayısı
![]() (A) Kütle numarası= proton + nötron
sayısı (Nükleon sayısı)(atom ağırlığı)
(A) Kütle numarası= proton + nötron
sayısı (Nükleon sayısı)(atom ağırlığı)

İzotop atom: Proton sayıları (atom numaraları)aynı, nötron sayıları farklı olan atomlara denir.
İzotop atomların kimyasal özellikleri aynı (p aynı) , fiziksel özellikleri farklıdır (n farklı).
Nötr halde bulunmayan, iyon halindeki izotop atomların hem fiziksel, hem kimyasal özellikleri farklıdır.
Elektronlar Nerede Dönüyor?
Elektronlar çekirdek çevresindeki katmanlarda (yörüngelerde) dönerek hareket ederler. Çekirdeğe en yakın katman 1 olmak üzere dışa doğru 2, 3,4... olarak katmanlar numaralandırılır. (bu katmanlar çember değil, küre yüzeyi olarak düşünülmelidir.)
Her katmanda bulunabilecek elektron sayısı bellidir.
1. Yörüngede en çok 2 elektron
2. Yörüngede en çok 8 elektron
3. Yörüngede en çok 18 elektron
4. Yörüngede en çok 32 elektron
5. Yörüngede en çok 32 elektron
6. Yörüngede en çok 18 elektron
7. Yörüngede en çok 8 elektron bulunur.
![]() Bir atomun ilk yörüngesi en fazla 2 elektron,
son yörüngesi en fazla 8 elektron taşır.
Bir atomun ilk yörüngesi en fazla 2 elektron,
son yörüngesi en fazla 8 elektron taşır.
![]() Bir nötr atom çekirdeğindeki proton sayısı
kadar elektron taşır.
Bir nötr atom çekirdeğindeki proton sayısı
kadar elektron taşır.
Elektron Alışverişi Ve Sonuçları:
Helyum (2), neon (10), argon (18)in elektron dağılımlarını aşağıda yapalım:
Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. Çünkü her üçünün de en dıştaki katmanları tamamen dolu durumdadır.
1.Katmanda en çok 2 elektron bulunması durumu dublet kuralı, 2. ve 3. katmanlarda en çok 8 elektron bulunması durumu oktet kuralı olarak adlandırılır. Helyum dublet, neon ve argon oktet kuralına uyar. Oktet veya dublet kuralına uyan atomlar kararlı yapıya sahiptir.
Diğer elementler de kararlı yapıya sahip olmak isterler. Bu yüzden elektron alır veya verirler.
Son yörüngesindeki elektron sayısı az olan lityum (3), berilyum (5) gibi elementler elektron verme eğilimindedir.
Oksijen(8), flor(9) elementleri ise elektron (bilgi yelpazesi.net) almaya yatkındır.
Atomlar elektron alarak veya vererek kararlı yapıya ulaştıklarında artık, iyon olarak adlandırılırlar.
Nötr bir atomun elektron almış veya vermiş haline iyon denir.
Atom elektron alarak kararlı hale geçerse elektron sayısı>proton sayısı olur. Bu tür iyonlara negatif (-) yüklü iyon (anyon) denir.
Atom elektron vererek kararlı hale geçerse elektron sayısı<proton sayısı olur. Bu tür iyonlara pozitif (+) yüklü iyon (katyon) denir.
Atomlar kaybettikleri elektron sayısı kadar +yüklü, kazandıkları elektron sayısı kadar yüklü olurlar.
Not: iyon yükü =proton sayısı- elektron sayısı
Eğer iyon anyonsa sembolün sağ üst kısmına işareti konur ve aldığı elektron sayısı yazılır. Katyonsa + işareti konur ve sayısı yazılır.
|
|
>>>TIKLAYIN<<<
FEN BİLİMLERİ DERSİ İLE İLGİLİ TEST SORULARI, SORU BANKASI
SAYFASINI
GÖRMEK İSTERSENİZ
>>>TIKLAYIN<<<
FEN BİLİMLERİ DERSİ İLE İLGİLİ YAZILI SORULARI SAYFASINI GÖRMEK İSTERSENİZ
>>>TIKLAYIN<<<
| ||||